Identification unique de l’appareil (UDI)
Services à l’international
Home / Étiquetage UDI
Étiquetage UDI
Le 24 septembre 2013, la FDA (Food and Drug Administration) aux États-Unis a publié une règle finale exigeant que la plupart des appareils médicaux distribués aux États-Unis disposent d’identifiants uniques d’appareils (UDI). Le système UDI facilite l’identification des appareils médicaux, leur traçabilité et leur suivi tout au long de leur distribution et utilisation. Cette règle exige que les informations produit relatives aux appareils soient enregistrées dans la base de données d’identification unique internationale des appareils (GUDID) de la FDA.
De plus, la règle exige également qu'un nouveau format de date standard soit apposé sur toutes les étiquettes des appareils médicaux.
Masimo a mis à jour notre étiquetage pour être en conformité avec la réglementation UDI et les normes GS1.
Si vous avez des questions qui dépassent le cadre de ces FAQ, veuillez contacter le Service client :
États-Unis : [email protected]
En dehors des États-Unis : [email protected]
Questions fréquemment posées
Questions fréquemment posées
1. Qu’est-ce que l'identification unique de l’appareil (UDI) ?
Une identification unique de l'appareil (UDI) est une série de caractères numériques ou alphanumériques basés sur une norme de codage internationale qui identifie correctement un appareil au point de distribution et au point d'utilisation. Un UDI est composé de :
- Un identifiant de l'appareil, le GTIN (Global Trade Item Number - Code article international) : une partie fixe obligatoire d'un UDI identifiant la version spécifique ou le modèle d'un appareil et l'étiqueteuse de cet appareil ; et
- Un identifiant de production : une partie variable conditionnelle d'un UDI qui identifie un ou plusieurs éléments suivants lorsqu'ils sont inclus sur l'étiquette de l'appareil :
- Le lot ou l'unité de production de l'appareil ;
- Le numéro de série d'un appareil spécifique ;
- La date d'expiration d'un appareil spécifique ; et/ou
- La date de fabrication d'un appareil spécifique.
Masimo utilise GS1 comme organisme accrédité pour l'attribution des codes-barres et des structures de code-barres.
Veuillez noter que tout produit qui n'est PAS classé comme appareil médical ne requiert pas de code-barres.
2. Qui doit se conformer à la réglementation UDI ?
Toutes les entreprises d'appareils médicaux doivent se conformer à la réglementation UDI.
3. Quel est le délai de mise en œuvre pour se conformer à la réglementation UDI ?
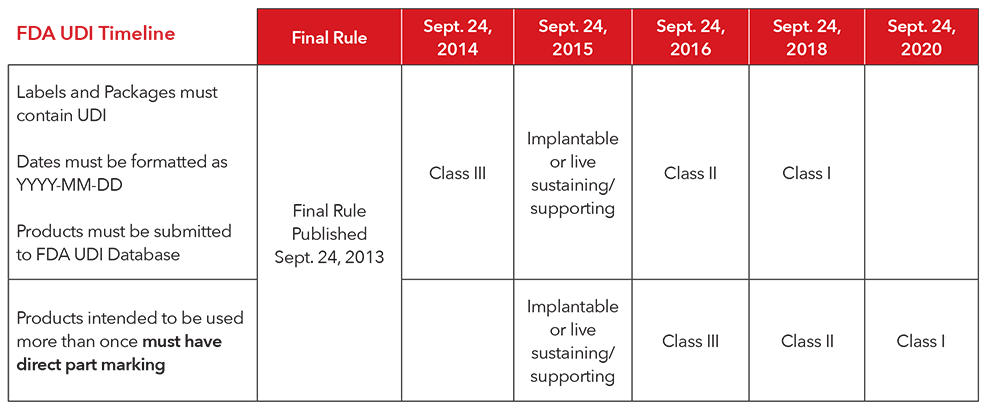
** Masimo est volontaire pour le marquage direct de tous les produits réutilisables. Les produits Masimo ne doivent pas être nécessairement marqués directement conformément au règlement actuel de la FDA.
4. Comment Masimo se conformera-t-il à l'UDI ?
Masimo distribue des produits de classe II et quelques produits de classe I. Masimo a mis à jour notre étiquetage pour être en conformité avec la réglementation UDI et les normes GS1.
Veuillez noter que tout produit qui n'est PAS classé comme appareil médical ne requiert pas de code-barres.
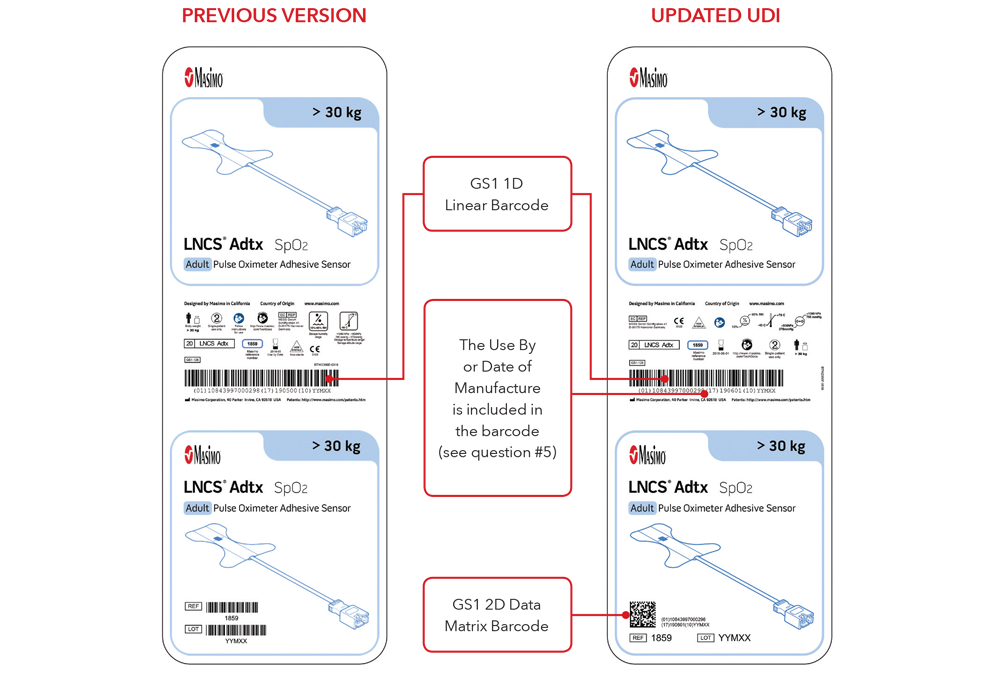
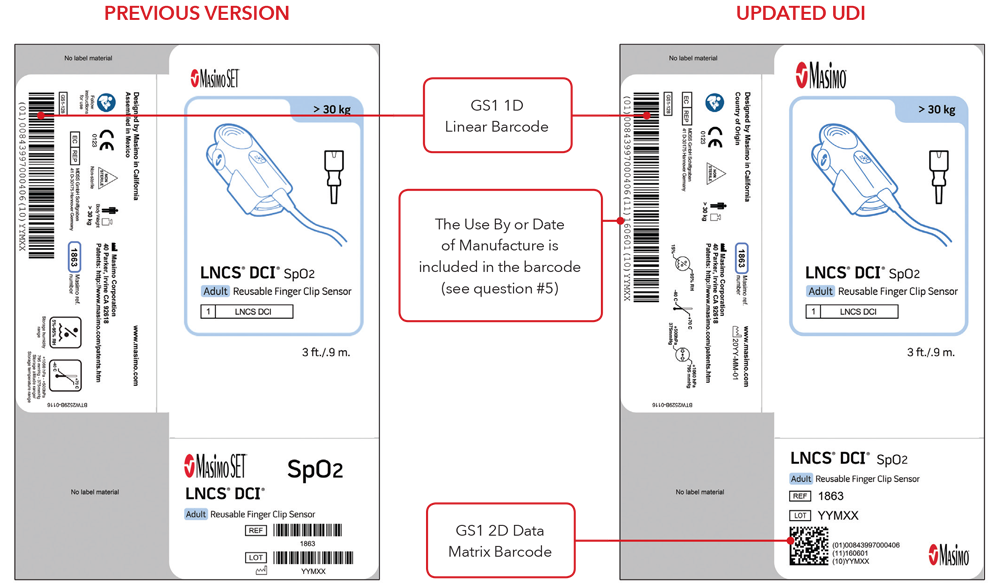
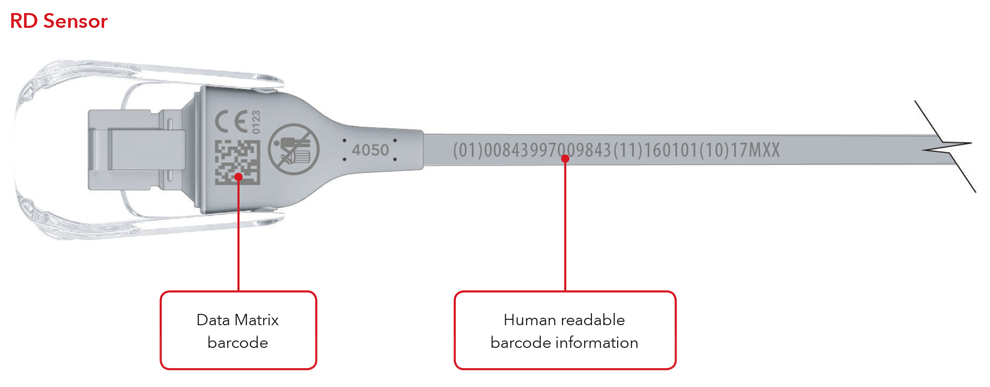
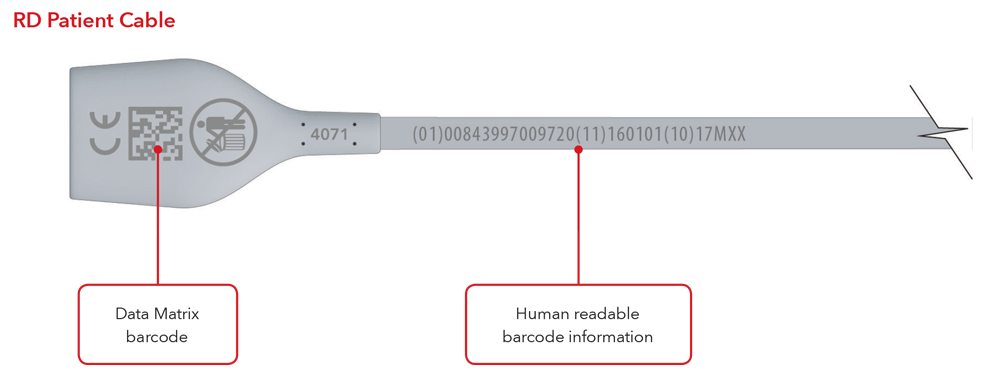
5. À quoi ressembleront mon étiquette UDI et le marquage direct ?
Voici des exemples de :
- Étiquettes de boîte de capteur avec la version précédente et les étiquettes UDI mises à jour
- Capteur avec marquage direct
- Câble avec marquage direct
Remarque : selon le type de produit, l'étiquette comprendra une ou deux dates. Pour les produits qui ont une date de péremption, elle apparaîtra sous le format AAAA-MM-JJ, sous le symbole d'expiration et sera également codée sous le format AAAA-MM-JJ, précédée de l'identifiant de production (17) dans les codes-barres GS1 et 2D. Pour les produits qui n'ont pas de date de péremption, la date de fabrication apparaîtra sous le format AAAA-MM-JJ, à côté du symbole de la date de fabrication et sera également codée sous le format AAAA-MM-JJ, précédée de l'identifiant de production (11) dans les codes-barres GS1 et 2D.
Exemples d'étiquette de boîte de capteur
Exemples de capteur et de câble avec marquage direct
6. Qu'est-ce qu'un code article international (Global Trade Item Number - GTIN) ?
Un GTIN est un numéro d'identification GS1 unique utilisé pour identifier un « article commercial ». Les GTIN sont attribués par le propriétaire de la marque (étiqueteur) du produit et sont utilisés pour identifier les produits de la chaîne d'approvisionnement international à l'utilisateur final, tel qu'un hôpital. Si vous n'utilisez pas actuellement le système GS1 avec les GTIN pour gérer vos produits, vous devrez vous procurer les GTIN pour les produits que vous achèterez.
Pour plus d'informations sur les GTIN, veuillez contacter GS1 à l'adresse suivante : https://www.gs1us.org/resources/standards.
7. Comment puis-je obtenir des GTIN de produits ?
Envoyez un e-mail au Service client de Masimo :
États-Unis : [email protected]
En dehors des États-Unis : [email protected]
Veuillez inclure votre numéro de client et la référence du(es) produit(s) dans l'e-mail.
8. Je suis actuellement en train de saisir ou de scanner des barres-codes de LOT et/ou de RÉF. de Masimo sur l'étiquette. Dois-je m'attendre à des perturbations ?
Oui. Les codes-barres de LOT ou de RÉF. sur l'étiquette doivent être supprimés et remplacés par du texte et ne pourront plus être scannés. Pour les informations relatives au LOT, scannez le code-barres GS1 ou localisez-le à côté du symbole LOT sur l'étiquette. Les informations relatives à la RÉF. peuvent être identifiées dans le GTIN correspondant. Pour plus d'informations sur les GTIN, voir la question 6 ci-dessus.
9. Les numéros de produits Masimo changeront-ils à mesure que l'étiquetage UDI est mis en place ?
Non, les numéros de produits Masimo resteront les mêmes.
10. Quel est le nouveau format de date standardisé et quand entre-t-il en vigueur ?
La réglementation UDI a adopté le format de date standardisé AAAA-MM-JJ sur les étiquettes des appareils. Les dates sur les étiquettes adopteront le nouveau format au plus tard à la date à laquelle l'étiquette de l'appareil doit porter un UDI. Pour plus d'informations sur les délais de mise en œuvre, voir la question 3 ci-dessus.
11. Est-ce que Masimo fournira des informations en ligne relatives au produit ?
Le GUDID est une base de données consultable publiquement qui contient la partie relative à l'identification de l'appareil (DI) de l'UDI pour chaque appareil médical ainsi que d'autres informations requises sur le produit. Toutes les entreprises d'appareils médicaux doivent soumettre des informations relatives au DI au GUDID. Masimo a commencé à renseigner le GUDID et veillera à ce que tous les produits soient ajoutés en fonction, ou avant les délais de mise en œuvre de l'UDI.
12. Qu'en est-il des stocks existants ? Les fabricants doivent-ils les marquer à nouveau ?
Non, il existe deux exceptions pour les stocks existants :
- Les appareils qui sont commercialisés avant la date de conformité applicable n'ont pas à se conformer à la règle finale.
- Les appareils qui sont fabriqués et étiquetés avant la date de conformité applicable sont également exemptés. Cependant, cette exception expire 3 ans après la date de conformité applicable.
13. Tous les appareils doivent-ils être marqués directement avec leurs UDI ?
Non. La règle exige seulement le marquage direct pour les appareils médicaux réutilisables qui doivent être retraités (nettoyage / stérilisation de niveau élevé) avant d'être réutilisés.
Masimo est volontaire pour le marquage direct de tous les produits réutilisables. Les produits Masimo ne doivent pas être nécessairement marqués directement conformément au règlement actuel de la FDA. Pour plus d'informations sur les délais de marquage direct, voir la question 3 ci-dessus.
Pour plus d'informations sur le système UDI, consultez l'Identification unique de l'appareil (UDI) sur le site Web de la FDA :
http://www.fda.gov/MedicalDevices/DeviceRegulationandGuidance/UniqueDeviceIdentification/
Si vous avez des questions supplémentaires sur la conformité de Masimo par rapport à la réglementation UDI, veuillez contacter le Service client de Masimo à l'adresse suivante :
États-Unis : [email protected]
En dehors des États-Unis : [email protected]
PLCO-002192/PLM-001458A-0818 EN-PLMM-10045C